高中化学必修一试题(高一必修1化学试卷分享)
高中化学必修一试题(高一必修1化学试卷分享)
相对原子质量: H 1 C 12 O 16 Na 23 Mg 24 S 32 Cl 35.5
一、选择题(每小题均有一个选型符合题意,选项填入答题框中,每小题3分,共48分)
1. 过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
2. 下列溶液中c(Cl-)与50mL 1 mol∙L-1 AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol∙ L-1氯化钠溶液 B. 75 mL 2 mol∙ L-1氯化钙溶液
C. 150 mL 2 mol∙ L-1氯化钾溶液 D. 75 mL 1 mol∙ L-1氯化铁溶液
3. 下列实验操作中错误的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取碘水中的碘时,可选择苯或四氯化碳作为萃取剂
4. 下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体
A.①和② B.①和③ C.③和④ D.①和④
5. 现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和漏斗,从缺少仪器的角度分析,不能进行的实验项目是( )
A.过滤 B.蒸发 C.分液 D.蒸馏
6. 下列叙述正确的是( )
A.1mol H2O的质量是18g/mol B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g D.标准状况下,1mol任何物质体积均为22.4L
7. 过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
8. 下列仪器常用于物质分离的是( )
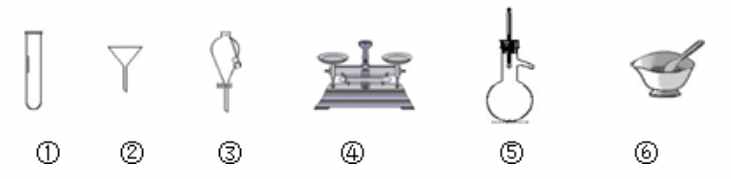
A. ①③⑤ B.②③⑤ C.②④⑤ D.①②⑥
9.已知1.505×1023个X气体分子的质量为16g,则X气体的摩尔质量是( )
A.16g B.32g C.64g/mol D.32g/mol
10.一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是( )
A. 原子数 B. 分子数 C. 体积 D. 物质的量
11.用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4LH2O含有的分子数为1NA
B. 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA
C. 通常状况下,1NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA
12.根据阿伏加德罗定律,下列叙述中不正确的是( )
A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于体积之比C.同温同压下两种气体的摩尔质量之比等于密度之比D.同温同体积下两种气体的物质的量之比等于压强之比
13. 欲配制100mL 1.0mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4溶于100 mL水中②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL③将20mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A. ①② B. ②③ C. ①③ D. ①②③
14. 除去下列溶液中的杂质(括号内是杂质)加入适量的试剂不正确的是( )
A. KOH溶液 [K2CO3]:用Ca(OH)2溶液
B. NaOH溶液[Ba(OH)2]:用Na2SO4溶液
C. HNO3溶液[HCl]:用AgNO3溶液
D. NaCl溶液(Na2SO4):用Ba(NO3)2溶液
15. 在三个密闭容器中分别充入CO2、H2、O2三种气体,当它们的温度和密度都相同,这三种气体的压强(p)从大到小的顺序是( )
A.p(H2)>p(O2)>p(CO2) B.p(O2)>p(CO2)>p(H2) C.p(CO2)>p(H2)>p(O2) D.p(H2)>p(CO2)>p(O2)
16. 在标况下,一个装满CL2的容器质量为74.6克;若装满N2则重为66克,那么此容器的容积为( )
A. 22.4升 B. 44.8升 C.11.2升 D.4.48升
二、填空题(52分)
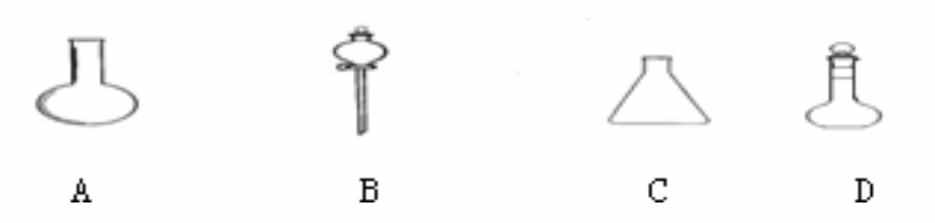
21.(10分)(1)如图所示A、B、C、D四种仪器;
请写出仪器的名称,填入相应的空格内:
(2) 实验室检验某溶液中是否含有SO42-的操作方法是
实验室检验某溶液中是否含有Cl-的操作方法是 。
(3)选择下列实验方法分离物质,将分离方法的序号填写在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
22.(8分)同温同压下,(1)同体积的氨气和硫化氢气体(H2S)的质量比为_______。(2)同质量的氨和硫化氢气体的体积比为_______,其中含有的氢的原子个数比为_______。(3)若二者氢原子数相等,它们的体积比为_______。
23.(12分)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏伽德罗常数用NA表示,则:
(1)该气体的物质的量为 mol;(2)该气体所含原子总数为 个;
(3)该气体在标准状况下的体积为 L;
(4)该气体溶于1 L水中(不考虑反应),其溶液中的溶质的质量分数为 ,设溶液的密度为ρ g/cm3,则该溶液的物质的量的浓度为 mol/L;
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为 mol/L。(各2分)
25.(17分)实验室用密度为1.2g/mL,质量分数为36.5%浓盐酸配制240mL 0.4mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制240mL 0.4mol/L的盐酸溶液,应量取盐酸体积______mL,除烧杯、量筒、玻璃棒外还需要的其他仪器_ __。
(2)配制时,其正确的操作顺序是(简要说明步骤)__ _____;(3分)
(3)若出现如下情况,对所配溶液浓度将有何影响(填"偏高"、"偏低"或"无影响")?
若没有进行A操作________;容量瓶洗后未干燥_________;若定容时俯视刻度线___________;取用浓盐酸的量筒洗后未干燥_________;取用浓盐酸时仰视量筒_________。(各2分)
三、计算题(7分)
26. 常温下,将80mL 20% 溶液加入95g蒸馏水后,溶液中溶质的质量分数变为10%。
1、原溶液的物质的量浓度 ;(2分)
2、原溶液中MgCl2物质的量为 ,其所含Mg2+的数目为 ,CL-的数目为 ;(各1分)
3、欲将其中的Mg2+完全沉淀,需要加入1mol/L的NaOH溶液 mL(2分)